ホウ酸
| ホウ酸 | |
|---|---|
 |  |
 | |
ホウ酸 | |
別称 オルトホウ酸 サッソライト | |
| 識別情報 | |
| CAS登録番号 | 10043-35-3  |
| PubChem | 7628 |
| ChemSpider | 7346  |
| UNII | R57ZHV85D4  |
| EC番号 | 233-139-2 |
| E番号 | E284 (防腐剤) |
| |
| |
| 特性 | |
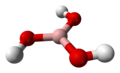
| 化学式 | B(OH)3 |
| モル質量 | 61.833 g mol−1 |
| 外観 | White crystalline solid |
| 密度 | 1.435 g cm−3, 固体 |
| 融点 | 169°C (分解) |
| 水への溶解度 | 5.7 g/100 cm3 (25°C) |
| 酸解離定数 pKa | 9.24 |
| 構造 | |
| 分子の形 | 平面三角形 |
| 双極子モーメント | 0 |
| 熱化学 | |
| 標準生成熱 ΔfH | −1094.33 kJ mol−1 |
| 標準モルエントロピー S | 88.83 J mol−1K−1 |
| 標準定圧モル比熱, Cp | 81.38 J mol−1K−1 |
| 危険性 | |
| NFPA 704 |  0 1 0 |
| 引火点 | 無し |
| 関連する物質 | |
| 関連物質 | 酸化ホウ素 ホウ砂 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ホウ酸(ホウさん、硼酸、Boric acid)もしくはオルトホウ酸は化学式H3BO3またはB(OH)3で表わされるホウ素のオキソ酸である。温泉などに多く含まれ、殺菌剤、殺虫剤、医薬品(眼科領域)、難燃剤、原子力発電におけるウランの核分裂反応の制御、そして他の化合物の合成に使われる。常温常圧では無色の結晶または白色粉末で、水溶液では弱い酸性を示す。ホウ酸の鉱物は硼酸石(サッソライト)と呼ばれる。メタホウ酸や四ホウ酸などホウ素のオキソ酸を総称してホウ酸と呼ばれることもある[1]。
合成
ホウ酸は主にホウ酸塩鉱物に硫酸を反応させて作られる。世界最大のホウ酸塩の産出地はトルコのEti Mine Worksである[2]。
酸性酸化物である三酸化二ホウ素 (B2O3)を水に溶解しても生成する。
これらの方法で得られたホウ酸溶液から、ホウ酸の溶解度が温度によって大きく異なることを利用した再結晶法を利用してホウ酸の結晶が分離される[3]。
化学的性質
無色の結晶であり、水に対する溶解は吸熱的である[4]。そのため、10℃の冷水に対する溶解度は3.65 g/100 mLでしかないが、100℃の熱湯に対する溶解度は37.9 g/100 mLと、温度上昇に伴い溶解度が大幅に上昇する[1]。
- ,
加熱により順次水を失い、まず130℃付近からメタホウ酸(HBO2)を生成し、更なる加熱により酸化ホウ素となる。メタホウ酸は単純なHBO2分子ではなく、BO4四面体を酸素原子が架橋したポリ酸である[5]。過去にはメタホウ酸から酸化ホウ素に変化する過程の中間生成物として四ホウ酸(H2B4O7)が生成すると考えられていたが、これは誤りであることが判明している。四ホウ酸は遊離酸としてはホウ酸溶液中にわずかに存在するのみであり、多くは四ホウ酸ナトリウムなどの塩の形で存在する[6]。
化学式からは 3 価の酸と予想されるが、水溶液中ではそのような酸解離は認められず、ルイス酸として働き、水酸化物イオンを受け取り、4配位となる化学平衡が存在する[5]。
- , pKa
酸解離に関する標準エンタルピー変化、ギブス自由エネルギー変化、エントロピー変化の値が報告されており[4]、解離に伴いエントロピーの減少が起こるのは、電荷の増加に伴い、イオンの水和の程度が増加し、電縮が起こり、水分子の水素結合による秩序化の度合いが増加するからである[7]。
| 14.12 kJ mol−1 | 52.71 kJ mol−1 | −129.7 J mol−1 K−1 | −192 J mol−1 K−1 |

酸解離定数が小さいため、中和滴定曲線において当量点は不明瞭となり、塩基による中和滴定は困難であるが、エチレングリコールなどを加えるとエステルを形成し酸解離定数が大きくなり、中和滴定が可能となる[5]。
また、ホウ酸を純硫酸に溶解すると硫酸水素イオンと錯体を形成し、硫酸中で強酸として働く数少ない物質となる[5]。
毒性
ホウ酸は水酸基を2個以上もつある種の有機化合物と強固なキレート結合を形成する。生体内でおこる食物をエネルギーに変える代謝反応では、糖、アミノ酸、リン酸などを要素とする多数の補酵素(コエンザイム)が働くが、ホウ酸が糖に由来する水塩基と結合することで補酵素の機能を失わせ、代謝を停止させる働きがある。腎臓を持つ哺乳動物は、ホウ酸を摂取しても細胞に届く前に腎臓で濾過され、体外に排出されるためホウ酸の毒性は微弱であるものの、昆虫やダニ、菌類、バクテリアなどに対しては厳しく作用する。[8]
ホウ酸は水溶性のため扱いやすい反面溶脱しやすいが、揮発や分解されないためシックハウス症候群の原因にならず、効果も長続きする[9]。この特性のため、直接殺虫剤を摂取した生物だけでなくその死骸や排泄物を摂取した生物も駆除できる。また、ホウ酸を付加した物体から他の物体へ浸みこむことで、付加した物体に落ちたものを摂取した生物や、産み付けられた卵に対しても効果を発揮する[10][11]。
半数致死量 (LD50)は 5 g/kg 程度で、体重60 kg では約300 g で半数致死量となる[12]。継続してホウ酸を摂取すると下痢など消化器系の不良が生じる可能性がある[13]。
その濃度毒性を利用し、通常殺虫剤として利用される[14]ほか、欧米では建築用木材で、シロアリや菌類への防虫防腐剤として塗布されている事が多い。近年では日本でも毒性の低さと長期有効性から優良住宅認可/認定され始め注目を浴びている。
植物では濃度にもよるが、1年草全般で有害であり、樹木によってはギンモクセイやゴールドクレストなどはホウ酸に弱い。逆に少量では必須栄養素となり肥料として市販もある。土壌から抜けにくいため施肥濃度には注意を要する。作物から人体への影響はほとんどない。
用途
- 水酸化カリウム水溶液の中和剤としても用いられる。工業用メーカーは、アメリカ合衆国・トルコ・ロシア・チリ・ペルー・アルゼンチン。日本は全量を輸入に依存。用途はホウ酸塩ガラス、ガラス繊維、ホウ素系合金鉄、目に入った場合の中和(後述)。
- ホウ素の高い中性子捕獲能力を利用して、原子炉の核分裂で生成する熱中性子への毒物質[注 1]として利用される。この場合は容易に水溶するホウ酸として利用することが多く、ホウ酸水の場合は冷却材も兼ねる。なお、放射性核種の原子核崩壊は熱中性子がなくても自発的に起こるものであるため、吸収剤としてのホウ素は役に立たない。従って、崩壊熱で原子炉が高温となる状態は、別の手段で冷却を行う必要がある。
- 小学校5年の理科の実験(物の溶け方)で溶解度の実験を行なう際、食塩(塩化ナトリウム)と並ぶ代表的な試薬。ホウ酸のほうが溶解度が低いため、水に良く溶ける塩化ナトリウムと溶解度を比較したり、水温を上げた場合に両薬品の溶け方がどう変化するかなどの実験で用いられる。
- ゴキブリ駆除の食毒剤として、ホウ酸団子 (10 % - 50 %) が使用される場合がある。完成された市販品があるほか、タマネギ・米ぬか・ジャガイモをペースト状にして、ホウ酸を混入させることで自作することも可能だが、ペットが誤飲すると、脱水で死に至る場合がある。市販の「ゴキブリキャップ」などは、ホウ酸と餌の混合物を収容ケース内に収めたもので、ゴキブリは収容ケースに開けられた小さな穴を通過し内部の毒餌を食べることができる。ホウ酸濃度が高いと(30%以上)二次駆除も可能となる。
- シロアリ防除薬剤としてホウ酸が用いられる場合も増えてきている。各シロアリの毒性閾値はイエシロアリで3.0、ヤマトシロアリで<3.0、アメリカカンザイシロアリで1.0(kg/㎥BAE)。
- アリ駆除にホウ酸液が使用される場合がある。ホウ酸1: 砂糖1: 水適量 (約10)※溶媒のH2Oはお湯でなければ溶けない。市販の「アリメツ」もそれに類似した製剤である。また、ホウ酸と糖蜜などとの混合物を収容ケース内に収めた製剤も用いられる。
- かつては農薬(殺虫剤)としても用いられていた。(現在は登録失効)
- 眼科領域においては、結膜嚢の洗浄と消毒に、また目薬の保存料としても用いられる。特に、塩基性の薬品が目に入った際の中和剤として用いられる。
- ホウ酸は単独では溶解度が低いが、特殊生成すると水への溶解度が大きく増加する。この濃い水溶液はセルロース用の難燃剤 (SOUFA: ソウファ)として用いられ、処理した木材は不燃木材として市販されている[15]。その他樹脂への応用が研究されている。
- 販売されなかった新聞を繊維状に加工し、ホウ酸を塗したものが、セルロースファイバーとして住宅用断熱材として利用される。日本では数パーセントの住宅に使用されているに過ぎないが、アメリカでは住宅用断熱材として40 % 前後のシェアを占めている。駆虫性・透湿性・耐水性・防火性・防音性を兼ね備えているが、施工に専用の機材を必要とするなどの欠点もある[16]。
結晶構造
ホウ酸の結晶は水素結合による層状構造からなる。層間の距離は318pmである。
 |  |
脚注
注釈
出典
- ^ a b 丸内 (2005) p.103。
- ^ Eti Mine Works.
- ^ 丸内 (2005) p.104。
- ^ a b Wagman et al. (1982).
- ^ a b c d コットン、ウィルキンソン (1987)。
- ^ 千谷 (1959) p.369。
- ^ 田中 (1981).
- ^ ホウ素系木材保存剤普及協会. “木材劣化生物とホウ酸塩”. NPO法人ホウ素系木材保存剤普及協会. 2024年3月10日時点のオリジナルよりアーカイブ。2024年3月10日閲覧。
- ^ ホウ素系木材保存剤普及協会. “ホウ酸塩ベースの表面処理剤”. NPO法人ホウ素系木材保存剤普及協会. 2024年3月10日時点のオリジナルよりアーカイブ。2024年3月10日閲覧。
- ^ ホウ素系木材保存剤普及協会. “素晴らしいホウ酸塩”. NPO法人ホウ素系木材保存剤普及協会. 2024年3月10日時点のオリジナルよりアーカイブ。2024年3月10日閲覧。
- ^ ホウ素系木材保存剤普及協会. “シロアリ駆除に効果的な「ホウ酸」”. 無添加計画. 2024年3月10日時点のオリジナルよりアーカイブ。2024年3月10日閲覧。
- ^ “safety data ホウ酸”. 日本医薬品添加剤協会. 2014年10月21日閲覧。
- ^ Nielsen, Forrest H. (1997). Plant and Soil 193 (2): 199. doi:10.1023/A:1004276311956.
- ^ Klotz, J. H.; Moss, JI; Zhao, R; Davis Jr, LR; Patterson, RS (1994). “Oral toxicity of boric acid and other boron compounds to immature cat fleas (Siphonaptera: Pulicidae)”. J. Econ. Entomol. 87 (6): 1534–1536. PMID 7836612.
- ^ 露本 第 3 回特許ビジネス市。
- ^ 山本 (2009).
参考文献
- 田中元治『酸と塩基』裳華房〈基礎化学選書 8〉、1981年。ISBN 978-4785331085。
- 千谷利三『新版 無機化学(上巻)』産業図書、1959年。
- 露本伊佐男. “不燃木粉ボード”. 第 3 回特許ビジネス市 in 東京. 2006年2月1日閲覧。
- 丸内祐子『実験化学講座 23 無機化合物』日本化学会 編、丸善、2005年。ISBN 4-621-07322-2。
- 山本順三『無垢材・無暖房の家』カナリア書房、2009年。ISBN 978-4778201166。
- FA コットン、G. ウィルキンソン(著)、中原 勝儼(訳)『コットン・ウィルキンソン無機化学』培風館、1987年。
- F. Albert Cotton and Geoffrey Wilkinson (1980). Advanced Inorganic Chemistry : A Comprehensive Text (fourth ed.). Wiley-Blackwell. ISBN 9780471027751 (原書)
- Eti Maden. “Dünyada Bor Rezervi(世界のホウ素埋蔵量)”. 2013年3月15日閲覧。[リンク切れ]
- D.D. Wagman, W.H. Evans, V.B. Parker, R.H. Schumm, I. Halow, S.M. Bailey, K.L. Churney and R.I. Nuttal (1982). “The NBS tables of chemical thermodynamics properties”. J. Phys. Chem. Ref. Data 11 (Suppl. 2). http://srd.nist.gov/JPCRD/jpcrdS2Vol11.pdf.
- “環境保健クライテリア No.204 ホウ素(日本語抄訳)”. 世界保健機関(WHO)/国連環境計画(UNEP)/国際労働機関(ILO)、国立医薬品食品衛生研究所. 2014年5月4日閲覧。
- “Environmental Health Criteria No.204 Boron”. 世界保健機関(WHO)/国連環境計画(UNEP)/国際労働機関(ILO). 2014年5月4日閲覧。(原文)
関連項目
外部リンク
- ホウ酸 理科ねっとわーく(一般公開版) - ウェイバックマシン(2017年10月4日アーカイブ分) -文部科学省 国立教育政策研究所
| |||
|---|---|---|---|
| 二元化合物 | |||
| 多元化合物 |
| ||
| | |||




![{\displaystyle {\ce {H3BO3 ->[\Delta] HBO2\ + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/62fcbe32559dfff69129c7a9aa1c5ad2b52f001c)
![{\displaystyle {\ce {2HBO2 ->[\Delta] B2O3\ + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/37fac0bc0c38a34427ab6147340b50f04b8dc04f)














