レジパスビル
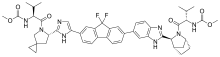 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 法的規制 |
|
| 投与経路 | Oral |
| 薬物動態データ | |
| 生物学的利用能 | 76% |
| 血漿タンパク結合 | >99% |
| 代謝 | No cytochrome metabolism |
| 半減期 | 47 hrs |
| 識別 | |
| CAS番号 | 1256388-51-8 |
| ATCコード | none |
| ChemSpider | 29271894 |
| KEGG | D10442  |
| ChEBI | CHEBI:85089en:Template:ebicite |
| 化学的データ | |
| 化学式 | C49H54F2N8O6 |
| 分子量 | 889.00 g/mol |
| |
| |
| テンプレートを表示 | |
レジパスビル(Ledipasvir)は、C型肝炎ウイルス(HCV)のNS5A(英語版)阻害効果を持つ化合物である。レジパスビルとソホスブビルを組み合わせて投与すると、HCV複製の直接的阻害効果を示し、インターフェロンまたはリバビリンを併用することなく、ジェノタイプ1aまたは1bのC型肝炎を治療することができる。レジパスビル・ソホスブビル合剤の商品名ハーボニー。
2013年の第20回レトロウイルスおよび日和見感染症学会(Conference on Retroviruses and Opportunistic Infections、CROI)で発表されたデータでは、ヌクレオチドアナログであるソホスブビル、レジパスビル、リバビリンの3剤併用療法のジェノタイプ1ウイルスに対する12週ウイルス学的著効率(SVR12)は100%であった。これには、未治療のC型肝炎も前治療に反応しなかった肝炎も含まれる[1][2]。
ソホスブビル・レジパスビル合剤についてリバビリン併用有無の両方の治療が試験された。2014年2月、インターフェロンおよびリバビリンの併用なしのソホスブビル・レジパスビル経口剤治療が米国FDAに承認申請され[3]、同年10月にレジパスビル90mg・ソホスブビル400mgの合剤が承認された[4]。日本では2015年7月に承認された[5]。開発コードGS-5885。
効能・効果
日本で承認されている効能・効果は正確には「セログループ1(ジェノタイプ1)のC型慢性肝炎またはC型代償性肝硬変におけるウイルス血症の改善」である[6]。
この合剤は未治療のC型肝炎にも既治療のC型肝炎にも有効である[7]。
禁忌
レジパスビル・ソホスブビル合剤はソホスブビル単剤と同じく以下の患者に禁忌である[6]。
- 重度の腎機能障害(eGFR < 30mL/分/1.73m2)または透析を必要とする腎不全の患者
- カルバマゼピン、フェニトイン、リファンピシンを服用中の患者
- セイヨウオトギリ (セント・ジョーンズ・ワート)含有食品を摂取している患者
- 製剤成分に対し過敏症の既往歴のある患者
慎重投与
B型肝炎ウイルス感染の患者または既往感染者では、B型肝炎ウイルスが再活性化することがある。
副作用
日本国内で実施したレジパスビル・ソホスブビル合剤の臨床試験で認められた副作用(計:21.7%)は、瘙痒症(3.2%)、悪心(2.5%)、口内炎(2.5%)等であった[6]。海外での臨床試験で認められた副作用は、疲労感、頭痛等であった[8]。
重大な副作用として、高血圧と脳血管障害が添付文書に記載されているが何方も頻度不明である。
相互作用
P糖蛋白質の影響を受けるため、P糖蛋白質を誘導するセイヨウオトギリやリファンピシン等と相互作用する。併用すると血中濃度が低下し、治療効果が減弱される[8]。
作用機序
レジパスビルはウイルスにとって重要なリン蛋白質であるNS5A(英語版)を阻害し、ウイルスの複製、組立、放出の過程を妨げる[9]。
一方のソホスブビルは代謝されてウリジン三リン酸のアナログとなり、NS5BポリメラーゼによるRNA鎖の伸長停止薬として作用する[9]。
その他
2017年1月、奈良県でソホスブビルとの配合剤(ハーボニー配合錠)の偽造品が流通していることが判明。厚生労働省は、都道府県や関係団体に文書で注意を呼び掛けた[10]。
出典
- ^ ELECTRON: 100% Suppression of Viral Load through 4 Weeks’ Post-treatment for Sofosbuvir + Ledipasvir (GS-5885) + Ribavirin for 12 Weeks in Treatment-naïve and -experienced Hepatitis C Virus GT 1 Patients. Gane, Edward et al. 20th Conference on Retroviruses and Opportunistic Infections. March 3–6, 2013. Abstract 41LB.
- ^ CROI 2013: Sofosbuvir + Ledipasvir + Ribavirin Combo for HCV Produces 100% Sustained Response. Highleyman, Liz. HIVandHepatitis.com. 4 March 2013.
- ^ “Gilead Files for U.S. Approval of Ledipasvir/Sofosbuvir Fixed-Dose Combination Tablet for Genotype 1 Hepatitis C”. Gilead Sciences (2014年2月10日). 2015年9月3日閲覧。
- ^ “U.S. Food and Drug Administration Approves Gilead’s Harvoni (Ledipasvir/Sofosbuvir), the First Once-Daily Single Tablet Regimen for the Treatment of Genotype 1 Chronic Hepatitis C” (2014年10月10日). 2014年10月10日閲覧。
- ^ “ジェノタイプ1型C型慢性肝炎治療薬1日1回1錠経口投与「ハーボニー配合錠」製造販売承認取得”. ギリアド・サイエンシズ (2015年7月3日). 2015年9月3日閲覧。
- ^ a b c “ハーボニー配合錠 添付文書” (2016年7月). 2016年7月31日閲覧。
- ^ Afdhal, N; Zeuzem, S; Kwo, P; Chojkier, M; Gitlin, N; Puoti, M; Romero-Gomez, M; Zarski, J. P. et al. (2014). “Ledipasvir and sofosbuvir for untreated HCV genotype 1 infection”. New England Journal of Medicine 370 (20): 1889-98. doi:10.1056/NEJMoa1402454. PMID 24725239.
- ^ a b Ledipasvir-Sofosbuvir (Harvoni) (PDF)
- ^ a b Ledipasvir-Sofosbuvir (Harvoni) Hepatitis C Online
- ^ C型肝炎薬に偽造品、厚労省注意呼びかけ…奈良 読売新聞オンライン(2017年01月17日)






