Alkan
 | Den här artikeln behöver källhänvisningar för att kunna verifieras. (2020-03) Åtgärda genom att lägga till pålitliga källor (gärna som fotnoter). Uppgifter utan källhänvisning kan ifrågasättas och tas bort utan att det behöver diskuteras på diskussionssidan. |

Inom kemin är en alkan ett mättat kolväte, det vill säga ett kolväte utan dubbelbindningar eller trippelbindningar mellan kolatomerna, vilka är placerade i en rak eller förgrenad kedja av enkelbindningar kol-kol.
Den generella summaformeln är CnH2n+2. Den minsta alkanen med n=1 är metan (CH4) och alkanen med exempelvis n=8 heter oktan, C8H18.
Alkanerna är relativt reaktionsobenägna - utom vid oxidation. Mildare oxidation med syrehaltiga ämnen ger upphov till alkoholer, ketoner, aldehyder eller karboxylsyror, fullständigare oxidation (förbränning) ger koldioxid och vatten samt (beroende på förbränningsgrad) varierande mängder av kolmonoxid. Ibland används ordet ”paraffin” i bred bemärkelse som samlingsbegrepp för alla alkaner (från latinets ”parum affinis”, ung. ”föga reaktiv”)[1]. Alkaner är opolära.
Alkaner utgör huvudbeståndsdelarna i bensin, dieselolja och jetbränsle/flygfotogen.
n-alkaner
- Se även: Högre alkaner
Den enklaste alkanen är metan. De tolv första n-alkaner ges i följande tabell. De utgör den homologa alkanserien.
| C | Namn | Summaformel | Molmassa | Smältpunkt | Kokpunkt | Densitet | Stavmodell |
|---|---|---|---|---|---|---|---|
| 1 | Metan | CH4 | 16,04 g × mol−1 | 90,65 K (−182,50 °C) | 111,4 K (−161,75 °C) | 0,72 kg/m3 (gasform, 0 °C, 1013 hPa) |  |
| 2 | Etan | C2H6 | 30,07 g × mol−1 | 90 K (−183 °C) | 185 K (−88 °C) | 1,36 kg/m3 (gasform, 0 °C, 1013 hPa) | 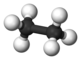 |
| 3 | Propan | C3H8 | 44,10 g × mol−1 | 85 K (−188 °C) | 231 K (−42 °C) | 2,01 kg/m3 (gasform, 0 °C, 1013 hPa) |  |
| 4 | n-butan | C4H10 | 58,12 g × mol−1 | 135 K (−138 °C) | 272,5 K (−0,65 °C) | 2,71 kg/m3 (gasform, 0 °C, 1013 hPa) |  |
| 5 | n-pentan | C5H12 | 72,15 g × mol−1 | 144 K (−129 °C) | 309 K (36 °C) | 0,626 g/cm3 |  |
| 6 | n-hexan | C6H14 | 86,18 g × mol−1 | 178 K (−95 °C) | 342 K (69 °C) | 0,659 g/cm3 | 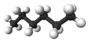 |
| 7 | n-heptan | C7H16 | 100,2 g × mol−1 | 182 K (−91 °C) | 371 K (98 °C) | 0,684 g/cm3 |  |
| 8 | n-oktan | C8H18 | 114,2 g × mol−1 | 216 K (−57 °C) | 399 K (126 °C) | 0,703 g/cm3 |  |
| 9 | n-nonan | C9H20 | 128,3 g × mol−1 | 222 K (−51 °C) | 424 K (151 °C) | 0,718 g/cm3 |  |
| 10 | n-dekan | C10H22 | 142,3 g × mol−1 | 243 K (−30 °C) | 447 K (174 °C) | 0,73 g/cm3 |  |
| 11 | n-undekan | C11H24 | 156,3 g × mol−1 | 248 K (−25 °C) | 469 K (196 °C) | 0,74 g/cm3 |  |
| 12 | n-dodekan | C12H26 | 170,3 g × mol−1 | 263 K (−10 °C) | 489 K (216 °C) | 0,75 g/cm3 |  |
Nomenklatur
För kedjor längre än fyra kolatomer, utgår IUPAC-nomenklatur för alkaner från det grekiska räkneordet för alkanens längsta kolkedja, följt av suffixet -an. Exempel: heptadekan C17H36, oktadekan C18H38, nonadekan C19H40, eikosan C20H42.
Se även
Referenser
- ^ ”paraffin”. SAOB. https://www.saob.se/artikel/. Läst 1 augusti 2020.
| |||||
| ||||||||||||||||||||









