Alloster reglering
Alloster reglering är då ett protein, ofta ett enzym, regleras genom inbindningen av en molekyl till proteinets allostera säte (ej att förväxla med proteinets aktiva säte). Regulatoriska molekyler som ökar proteinernas aktivitet kallas allostera aktivatorer, och de som minskar dess aktivitet kallas allostera inhibitorer. Termen alloster kommer från grekiskans allos (ἄλλος), "annat", och "stereos" (στερεὀς), "fast (form)" med hänvisning till det faktum att det regulatoriska sätet för allostera protein och dess aktiva säte är åtskilda. Alloster reglering är ett naturligt exempel på återkoppling, såsom i feedback-kontroll från reaktionsprodukter eller feedforward-kontroll från substrat i reaktionsvägen.
Modeller för alloster reglering
De flesta allostera effekter kan förklaras av den så kallade MWC-modellen (även eng. concerted model) framtagen av Jacques Monod, Wyman och Changeux,[1] eller av den sekventiella modellen (eng. sequential model) introducerad av Koshland, Nemethy och Filmer.[2] Båda modellerna postulerar att allostert reglerade enzymers subenheter kan befinna sig i en av två olika konformationer, spänd (eng. tense; T) eller avslappnad (eng. relaxed; R), och att avslappnade subenheter har högre affinitet för substrat än de har i det spända stadiet. De två modellerna skiljer sig främst i deras antaganden kring subenheternas interaktion och vad som föregår respektive stadium.
Alloster modulering
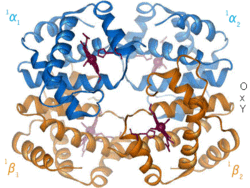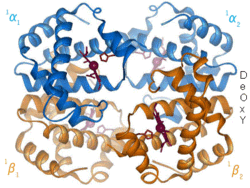
Positiv modulering
Positiv alloster modulering (även kallat alloster aktivering) är då inbindning av en ligand ökar affiniteten mellan substratmolekylerna och andra bindningsställen. Ett exempel är inbindningen av syremolekyler till blodets syrebärare hemoglobin, där syre både är substrat och effektor. Inbindningen av syre till en subenhet inducerar en konformationsändring i den subenheten som interagerar med övriga subenheters aktiva säten och därmed ökar dess affinitet för syre.
Negativ modulering
Negativ alloster modulering (även kallat alloster inhibering) är då inbindningen av en ligand minskar affiniteten för substratet vid andra aktiva säten. Till exempel agerar molekylen 2,3-BPG genom att binda till hemoglobins allostera kontrollsäte och på så vis minska affiniteten för syre vid övriga subenheter.
Referenser
- ^ J. Monod, J. Wyman, J.P. Changeux. (1965). ”On the nature of allosteric transitions:A plausible model.”. J. Mol. Biol. (12): sid. 88-118.
- ^ D.E. Jr Koshland, G. Némethy, D. Filmer (1966). ”Comparison of experimental binding data and theoretical models in proteins containing subunits.”. Biochemistry 5 (1): sid. 365-8.
| |||||||||||||||||










