Perättiksyra
| Perättiksyra | |
  | |
| Systematiskt namn | Etanperoxisyra |
|---|---|
| Övriga namn | Peroxyättiksyra, Ättiksperoxid |
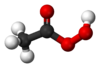
| Kemisk formel | CH3CO2OH |
| Molmassa | 76,0514 g/mol |
| Utseende | Färglös vätska |
| CAS-nummer | 79-21-0 |
| SMILES | CC(=O)OO |
| Egenskaper | |
| Densitet | 1,04 g/cm³ |
| Löslighet (vatten) | Blandbar |
| Smältpunkt | 0,1 °C |
| Kokpunkt | 105 °C |
| Faror | |
| Huvudfara |  Frätande Frätande Oxiderande Oxiderande |
| NFPA 704 |
2 3 4 OX |
| SI-enheter & STP används om ej annat angivits | |
Perättiksyra är en peroxid av ättiksyra som har formeln CH3CO2OH. Den är mycket svagare än ättiksyra (pKa = 8,2).
Framställning
Perättiksyra kan tillverkas på många sätt, men det vanligaste är att ättiksyra (CH3COOH) och väteperoxid (H2O2) får reagera med svavelsyra som katalysator.
Eftersom perättiksyra bygger upp kemisk jämvikt med ättiksyra och väteperoxid så kommer den färdiga produkten också att innehålla alla tre ämnen.
Användning
Organisk syntes
Det viktigaste användningsområdet för perättiksyra är framställning av epoxider genom att föra över en syreatom till en dubbelbindning.
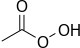 +
+ 
 +
+
Decinficering
Perättiksyra kan med fördel användas mot bakterier och andra mikroorganismer. Den bryts inte ner av katalas eller peroxidas.
Blekmedel
Perättiksyra används ofta för att bleka papper som tillverkats genom sulfatprocessen eller i andra applikationer där klorblekning inte är önskvärd.
Se även
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Peracetic acid, 14 oktober 2009.


















