Dioxyde de sélénium


Cet article ne cite pas suffisamment ses sources ().
Si vous disposez d'ouvrages ou d'articles de référence ou si vous connaissez des sites web de qualité traitant du thème abordé ici, merci de compléter l'article en donnant les références utiles à sa vérifiabilité et en les liant à la section « Notes et références ».
En pratique : Quelles sources sont attendues ? Comment ajouter mes sources ?
| Dioxyde de sélénium | |||
 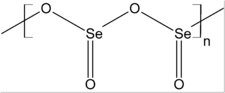  Apparence et structure du dioxyde de sélénium | |||
| Identification | |||
|---|---|---|---|
| No CAS | 7446-08-4 | ||
| No ECHA | 100.028.358 | ||
| No CE | 231-194-7 | ||
| No RTECS | VS8575000 | ||
| PubChem | 24007 | ||
| SMILES | O=[Se]=O PubChem, vue 3D | ||
| InChI | Std. InChI : vue 3D InChI=1S/O2Se/c1-3-2 Std. InChIKey : JPJALAQPGMAKDF-UHFFFAOYSA-N | ||
| Apparence | aiguilles blanches translucides solubles dans l'eau | ||
| Propriétés chimiques | |||
| Formule | O2SeSeO2 | ||
| Masse molaire[1] | 110,96 ± 0,03 g/mol O 28,84 %, Se 71,16 %, | ||
| Propriétés physiques | |||
| T° fusion | 315 °C[2] (sublimation) | ||
| Solubilité | 384 g·L-1 à 20 °C[2] | ||
| Précautions | |||
| SGH[2] | |||
   Danger H373 : Risque présumé d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) H410 : Très toxique pour les organismes aquatiques, entraîne des effets à long terme P273 : Éviter le rejet dans l’environnement. P314 : Consulter un médecin en cas de malaise. P304+P340 : En cas d'inhalation : transporter la victime à l’extérieur et la maintenir au repos dans une position où elle peut confortablement respirer. P309+P311 : En cas d'exposition ou de malaise : appeler immédiatement un CENTRE ANTIPOISON ou un médecin. | |||
| Transport[2] | |||
Code Kemler : 60 : matière toxique ou présentant un degré mineur de toxicité Numéro ONU : 3283 : COMPOSÉ DU SÉLÉNIUM, N.S.A Classe : 6.1 Étiquette :  6.1 : Matières toxiques Emballage : Groupe d'emballage II : matières moyennement dangereuses ; | |||
| Écotoxicologie | |||
| DL50 | 68,1 mg·kg-1 (souris, oral)[2] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
modifier  | |||
Le dioxyde de sélénium est un composé chimique de formule SeO2. Il s'agit d'un solide incolore se présentant sous la forme d'aiguilles blanchâtres translucides[3]. On peut l'obtenir par oxydation du sélénium aussi bien par combustion dans l'oxygène O2 de l'air que sous l'action de l'acide nitrique HNO3[3] ou du peroxyde d'hydrogène H2O2, la voie la plus efficace étant peut-être la déshydratation de l'acide sélénieux H2SeO3 :
Propriétés
Le dioxyde de sélénium solide est un polymère unidimensionnel constitué d'une chaîne où alternent des atomes d'oxygène et de sélénium. Les atomes de sélénium ont une géométrie pyramidale. Les liaisons Se–O ont une longueur de 162 pm. L'orientation des atomes d'oxygène est alternée le long de la chaîne d'atomes de sélénium et d'oxygène, ce qui correspond, du point de vue stéréochimique, à un arrangement syndiotactique.
En phase gazeuse, le dioxyde de sélénium forme des dimères et des oligomères, et devient monomérique à haute température. Le monomère présente une géométrie très semblable à celle du dioxyde de soufre SO2, avec des liaisons de 161 pm. Le dimère a été observé dans une matrice d'argon cryogénique, la spectroscopie infrarouge indiquant une géométrie centrosymétrique en chaise. La dissolution de l'oxydichlorure de sélénium (en) SeOCl2 donne le trimère [Se(O)O]3.
La molécule de SeO2 monomérique est polaire, avec un moment dipolaire de 2,62 D du milieu des deux atomes d'oxygène vers l'atome de sélénium[3].
Le dioxyde de sélénium solide se sublime facilement. À très faible concentration, la vapeur a une odeur repoussante rappelant celle du raifort en décomposition, et peut provoquer des sensations de brûlure, dans les muqueuses, à forte concentration ; ce composé est toxique, comme tous les composés du sélénium.
Le dioxyde de sélénium est un oxyde acide : il se dissout dans l'eau en donnant de l'acide sélénieux H2SeO3. Il réagit avec des bases en formant des sélénites, contenant l'anion SeO3−. Ainsi, la réaction avec l'hydroxyde de sodium NaOH donne du sélénite de sodium Na2SeO3 :
- SeO2 + 2 NaOH → Na2SeO3 + H2O.
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ a b c d et e Entrée « Selenium dioxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 23 mai 2017 (JavaScript nécessaire)
- ↑ a b et c (en) PubChem, « Selenium dioxide », sur pubchem.ncbi.nlm.nih.gov (consulté le )
v · m | |
|---|---|
| Séléniures Se(-II) | |
| Se(0,I) |
|
| Se(I) |
|
| Se(II) |
|
| Se(IV) |
|
| Se(VI) |
|
v · m | |
|---|---|
| États divers |
|
| État d'oxydation +1 |
|
| État d'oxydation +2 |
|
| État d'oxydation +3 |
|
| État d'oxydation +4 |
|
| État d'oxydation +5 |
|
| État d'oxydation +6 |
|
| État d'oxydation +7 |
|
| État d'oxydation +8 |
|
| Sujets connexes |
|
 Portail de la chimie
Portail de la chimie











