Trioxyde d'antimoine
| Trioxyde d'antimoine | ||
 | ||
 | ||
| Identification | ||
|---|---|---|
| Synonymes | anhydride antimonieux, | |
| No CAS | 1309-64-4 | |
| No ECHA | 100.013.796 | |
| No CE | 215-175-0 | |
| No RTECS | CC5650000 | |
| SMILES | [O-2].[O-2].[O-2].[Sb+3].[Sb+3] PubChem, vue 3D | |
| InChI | InChI : vue 3D InChI=1S/3O.2Sb/q3*-2;2*+3 InChIKey : GHPGOEFPKIHBNM-UHFFFAOYSA-N | |
| Apparence | solide blanc | |
| Propriétés chimiques | ||
| Formule | O3Sb2Sb2O3 | |
| Masse molaire[3] | 291,518 ± 0,003 g/mol O 16,46 %, Sb 83,54 %, | |
| pKa | ampholyte[2] | |
| Propriétés physiques | ||
| T° fusion | 656 °C (en l’absence de dioxygène)[2] | |
| T° ébullition | 1 425 °C[2] | |
| Solubilité | 14 mg·l-1 (eau, 30 °C)[1] | |
| Masse volumique | 5,2 g·cm-3 (sénarmontite)[2], 5,67 g·cm-3 (valentinite)[2] | |
| Pression de vapeur saturante | 1 mmHg à 574 °C[2] | |
| Cristallographie | ||
| Système cristallin | Cubique, Orthorhombique | |
| Propriétés optiques | ||
| Indice de réfraction | 2,087 (sénarmontite)[2], 2,18, 2,35 et 2,35 (valentinite)[2] | |
| Précautions | ||
| SGH | ||
| H351, P202, P281, P308+P313 et P405 H351 : Susceptible de provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) P202 : Ne pas manipuler avant d’avoir lu et compris toutes les précautions de sécurité. P281 : Utiliser l’équipement de protection individuel requis. P308+P313 : En cas d’exposition prouvée ou suspectée : consulter un médecin. P405 : Garder sous clef. | ||
| NFPA 704 | ||
1 2 0 | ||
| Directive 67/548/EEC | ||
 Xn Classification : 215-175-0 Symboles : Xn : Nocif Phrases R : R40 : Effet cancérogène suspecté. Risque possible d’effets irréversibles. Phrases S : S22 : Ne pas respirer les poussières. S36/37 : Porter un vêtement de protection et des gants appropriés. Phrases R : 40, | ||
| Classification du CIRC | ||
| Groupe 2B : peut-être cancérogène pour l’homme[2] | ||
| Écotoxicologie | ||
| DL50 | >20 g·kg-1 (rat, oral)[1] | |
| Composés apparentés | ||
| Autres composés | tétroxyde d'antimoine, | |
| Unités du SI et CNTP, sauf indication contraire. | ||
modifier  | ||
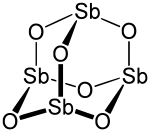
Le trioxyde d’antimoine, également appelé trioxyde de diantimoine ou oxyde d’antimoine(III), est un composé inorganique de formule Sb2O3. Il s’agit d’un oxyde d'antimoine se présentant au laboratoire sous la forme d’une poudre blanche, sa forme minérale étant la sénarmontite (cristaux cubiques incolores) ou la valentinite (cristaux orthorhombiques blancs).
La sénarmontite, stable à température ordinaire, se transforme à 570 °C en valentinite, métastable en dessous de cette température[1].
Écotoxicologie
En 2022, alors que les mécanismes de toxicité aquatique du Sb sont encore très mal compris, celle de la toxicité moléculaire du Sb(III) l'est plus encore, mais fait l'objet de quelques études[4]
Utilisations
Il est utilisé comme agent de synergie avec des composés halogénés pour l'ignifugation[5] des polymères et textiles ; opacifiant pour verres, céramiques et émaux ; pigment pour peintures et catalyseur chimique[1].
Notes et références
- ↑ a b c d et e INRS, Trioxyde de diantimoine, FT no 198, 2000, consulté le 12 septembre 2012.
- ↑ a b c d e f g h et i (en) Antimony trioxide, dans la base de données Hazardous Substances Data Bank, consulté le 12 septembre 2012.
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) Jihai Gu et Dongdong Lin, « Integrating transcriptome and physiological analysis to reveal the essential responses of Daphnia magna to antimony trioxide nanoparticle », sur Journal of Hazardous Materials, (ISSN 0304-3894, DOI 10.1016/j.jhazmat.2022.129303, consulté le ), p. 129303
- ↑ (en) « Flame retardant fact sheet: Antimony trioxide (Sb2O3) » [PDF], EFRA, (consulté le )
Voir aussi
Sur les autres projets Wikimedia :
- Trioxyde d'antimoine, sur Wikimedia Commons
Articles connexes
v · m | |
|---|---|
| Antimoniures | |
| Sb(0) |
|
| Sb(III) |
|
| Sb(III,V) |
|
| Sb(V) |
|
v · m | |
|---|---|
| États divers |
|
| État d'oxydation +1 |
|
| État d'oxydation +2 |
|
| État d'oxydation +3 |
|
| État d'oxydation +4 |
|
| État d'oxydation +5 |
|
| État d'oxydation +6 |
|
| État d'oxydation +7 |
|
| État d'oxydation +8 |
|
| Sujets connexes |
|
 Portail de la chimie
Portail de la chimie













