有機銅化合物


有機銅化合物(ゆうきどうかごうぶつ、英: organocopper compound)は有機金属化学において炭素と銅の結合を持つ化合物のことである[1][2][3]。これらは有機化学において試薬として使われる。
歴史
1859年、Rudolf Christian Böttgerは塩化銅 (I) 溶液にアセチレンを通すことで爆発性の銅(I)アセチリド Cu2C2(Cu-C≡C-Cu) を得た[4]。これは初めて合成された有機銅化合物である[4]。
1936年にHenry Gilmanはメチル銅を合成し、1941年にはKharashがCu (I) の存在下でグリニャール試薬とシクロヘキセノン反応が1,2-付加ではなく1,4-付加であることを発見した[5]。1952年にGilmanはジアルキルクプラートを初めて研究した。1960年代には銅 (I) のアルケンとCOによる錯体が発見された。
性質
有機銅化合物はH2OおよびO2と反応して酸化銅(I)になるなど、熱力学的に不安定である。ほとんどのクプラートはイオンであるので、一般に無極性溶媒には溶けない。よって有機銅試薬は単離せずにin situで利用され、Grignard試薬や有機リチウム試薬より官能基と反応しにくいことから特にアルキル化試薬として使われる。銅の電気陰性度は亜鉛などの第12族元素より高いので求核性が低いと考えられる。
銅の酸化数は一般に+1か+2であり、反応中間体では+3になることもある。1価のアルキル銅 (RCu) は繊維状の物質であり、有機リチウム化合物 (RLi) によりクプラート (R2CuLi) になる。このクプラートはGilman試薬と呼ばれる。有機銅化合物はアルキルホスフィン (R3P)、チオエーテル (R2S) およびシアン化物イオン (CN−) などのリガンドによって安定化する。
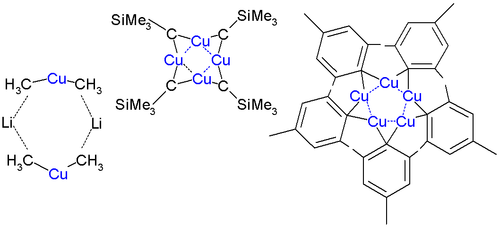
クプラート錯体は結晶および溶液中で複雑な複合体をつくる。ジメチル銅酸リチウムはジエチルエーテル中で2量化し、2つのリチウムがそれぞれ2つのメチル基に配位した8員環を形成する。同様にジフェニルクプラートリチウムのエーテル錯体は結晶中では2量体[{Li(OEt2)}CuPh2)]2として存在する[6]。
CuCH2SiMe3はクプラートとして初めて結晶構造が解明された化合物であり、1972年Lappertにより合成された。この化合物はトリメチルシリル基が分子全体を立体的に保護しているので比較的安定であり、Cu-C結合を含んだ8員環の4量体を形成する。またCu4環上の銅原子は3中心2電子結合をしている。Cu-Cuの結合距離は242 pmであり、バルクにおける値256 pmより短い。
ペンタメシチル銅では5員環が形成され、ペンタフルオロフェニル銅では4量化する[7]。
COと銅は非古典的金属カルボニル錯体を形成する。
Cu(III) 中間体
多くの有機金属反応で銅が関わるが、中間体において銅の酸化数が+3になることがある。しかし一般には珍しく、最近まで有機銅(III)化合物の性質はよくわからなかった。2007年になってGilmnan試薬のエノンへの共役付加でCu(III)が関与することが分光分析により初めて確かめられた[8]。−100 ℃でのNMRでGilman試薬Me2CuLi (ヨウ化リチウムで安定化) がシクロヘキセノン (1) に導入され検出可能な錯体 (2) になる。つぎにシアン化トリメチルシリルの付加によりCu(III)をもつ3が生成し、温度を−80 ℃に上げると共役付加により4が生成する。計算化学によるとCu(III) 中間体は平面四角形分子構造をとり、シアノ基はシクロヘキシルメチン基とcisの関係にあり、メチンのHとは逆平行である[9]。シアノ基以外をリガンドにもつ常温で安定なCu(III) 化合物が存在すると考えられている[9]。
合成
ハロゲン化銅は有機リチウム化合物と反応して有機銅化合物になる。フェニル銅はジエチルエーテル中でフェニルリチウムと臭化銅(I)により得られる。R-LiをR-Cuに対して2当量にするとジフェニル銅が生成する。ハロゲン化銅はGrignard試薬とも反応する。ペンタメシチル銅は臭化メシチルマグネシウムと塩化銅(I)から得られる。銅塩は末端アルキンと反応し銅アセチリドになる。銅メタロセンである (η-シクロペンタジエニルトリエチルホスフィン) 銅は酸化銅(II)、シクロペンタジエンおよびトリエチルホスフィンをペンタン中で還流することにより生成する。
反応
置換反応
Gilman試薬R2CuLiのハロゲン化アルキルR'-Xへの置換反応でアルキル銅R-Cu、カップリング生成物R-R'およびハロゲン化リチウムLi-Xが生成する。まずR'-Xの酸化的付加によってCu(I)が平面構造のCu(III)中間体になり、次に還元的脱離が起こる。R'-Xの求核攻撃が律速段階である。ヨウ化アルキルの置換では1電子伝達機構が考えられている[5]。

多くの求電子剤が使われ、反応性が高い順に示すと酸塩化物[10] > トシラート ~ エポキシド > ヨウ化アルキル > 臭化アルキル > 塩化アルキル > ケトン > エステル > ニトリル > アルケンとなる。
カップリング反応
酸化的カップリングには銅(I)アセチリドの共役アルキンへのGlaserカップリング (シクロオクタデカノナエンの合成など) やハロゲン化アリールへのCastro-Stephensカップリングがある。
還元的カップリングにはハロゲン化アリールと1当量の銅とのカップリングであるUllmann反応がある。脱炭酸的カップリングでは触媒量のCu(I)がカルボキシル基と置き換わってアリール銅 (ArCu) 中間体ができる。同時にパラジウム触媒が臭化アリールを有機パラジウム中間体 (Ar'PdBr) に変換し、トランスメタル化によりArPdAr'からビアリール (ArAr') が生成する[11][注 1]。
銅(I)塩は末端アルキンとハロゲン化アルキンのCadiot-Chodkiewiczカップリングを触媒する。また有機銅化合物の熱的なカップリングもある。
共役付加
有機銅化合物はエノンへの1,4-共役付加反応を触媒する。Grignard試薬 (RMgBr) を使うと1,2-付加が起こることもある[12]。1,4-付加では、まずアルケンのβ炭素へのCu(I)化合物の求核付加でCu(III)中間体ができ、つぎに還元的脱離によりCu(I)へ戻る[13]。たとえば臭化メチルマグネシウムとイソホロンの反応ではつぎのようになる[5]。
触媒なしではC=Oへの求核付加で生成したアルコールB (42%) および脱水したジエンC (48%) が主生成物である。一方、モル分率0.01%の塩化銅(I)の存在下では1,4-付加物A (82%) が主生成物であり、C (7%) は副生成物である。
1,6-付加反応も存在し、これはフルベストラントの工業生産に利用されている[14]。
カルボクプラート化
カルボクプラート化とは有機銅化合物 (R-Cu) のアセチレンや末端アルキンへの求核付加反応であり、アルケニル銅化合物 (RC=C-Cu)が得られる[15]。これはカルボメタル化の特別な場合であり、Normant反応とも呼ばれている[16]。
関連項目
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
脚注
参考文献
- ^ Gary H. Posner (1980). An introduction to synthesis using organocopper reagents. New York: Wiley: Wiley. ISBN 0-471-69538-6
- ^ W.A. Herrmann, ed (1999). Synthetic Methods of Organometallic and Inorganic Chemistry. 5, Copper, Silver, Gold, Zinc, Cadmium, and Mercury. Stuttgart: Thieme. ISBN 3-13-103061-5
- ^ Christoph Elschenbroich (2006). Organometallics (3 ed.). Weinheim: Wiley-VCH. ISBN 3-527-29390-6
- ^ a b R. C. Böttger (1859). “Ueber die Einwirkung des Leuchtgases auf verschiedene Salzsolutionen, insbesondere auf eine ammoniakalische Kupferchlorürlösung”. Annalen 109 (3): 351. doi:10.1002/jlac.18591090318.
- ^ a b c d Kharasch, M. S.; Tawney, P. O. (1941). Journal of the American Chemical Society 63 (9): 2308. doi:10.1021/ja01854a005.
- ^ N. P. Lorenzen, E. Weiss (1990). “Synthesis and Structure of a Dimeric Lithium Diphenylcuprate:[{Li(OEt)2}(CuPh2)]2”. Angew. Chem. Int. Ed. 29 (3): 300–302. doi:10.1002/anie.199003001.
- ^ A. Cairncross; et al. (1988). "Pentafluorophenylcopper tetramer, a reagent for synthesis of fluorinated aromatic compounds. [Copper, tetrakis(pentafluorophenyl)tetra]". Organic Syntheses (英語). 6: 875. Vol. 59, p.122 (1979)
- ^ a b Bertz, Steven H.; Cope, Stephen; Murphy, Michael; Ogle, Craig A.; Taylor, Brad J. (2007). “Rapid Injection NMR in Mechanistic Organocopper Chemistry. Preparation of the Elusive Copper(III) Intermediate1”. Journal of the American Chemical Society 129 (23): 7208–9. doi:10.1021/ja067533d. PMID 17506552.
- ^ a b Hu, Haipeng; Snyder, James P. (2007). “Organocuprate Conjugate Addition: The Square-Planar "CuIII" Intermediate”. Journal of the American Chemical Society 129 (23): 7210–1. doi:10.1021/ja0675346. PMID 17506553.
- ^ For an example see: G. H. Posner; et al. (1988). "Secondary and tertiary alkyl ketones from carboxylic acid chlorides and lithium phenylthio(alkyl)cuprate reagents: tert-butyl phenyl ketone. [1-Propanone, 2,2-dimethyl-1-phenyl]". Organic Syntheses (英語). 6: 248.; Vol. 55, p.122 (1976)
- ^ Goossen, L. J.; Deng, G; Levy, LM (2006). “Synthesis of Biaryls via Catalytic Decarboxylative Coupling”. Science 313 (5787): 662–4. Bibcode: 2006Sci...313..662G. doi:10.1126/science.1128684. PMID 16888137.
- ^ Organic Syntheses, Coll. Vol. 9, p.328 (1998); Vol. 72, p.135 (1995) Link.
- ^ Nakamura, Eiichi; Mori, Seiji (2000). “Wherefore Art Thou Copper? Structures and Reaction Mechanisms of Organocuprate Clusters in Organic Chemistry”. Angewandte Chemie 39 (21): 3750–3771. doi:10.1002/1521-3773(20001103)39:21<3750::AID-ANIE3750>3.0.CO;2-L. PMID 11091452.
- ^ Fulvestrant: From the Laboratory to Commercial-Scale Manufacture Eve J. Brazier, Philip J. Hogan, Chiu W. Leung, Anne O’Kearney-McMullan, Alison K. Norton, Lyn Powell,Graham E. Robinson, and Emyr G. Williams Organic Process Research & Development 2010, 14, 544–552 doi:10.1021/op900315j
- ^ Organic Syntheses, Coll. Vol. 7, p.236 (1990); Vol. 64, p.1 (1986) Link
- ^ Normant, J; Bourgain, M. (1971). “Synthese stereospecifique and reactivite d' organocuivreux vinyliques”. Tetrahedron Letters 12 (27): 2583. doi:10.1016/S0040-4039(01)96925-4.

![A Cu(III) intermediate characterized by NMR.[8]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ed/CopperIII_intermediate_by_RI_NMR.png/400px-CopperIII_intermediate_by_RI_NMR.png)

![Addition of methylmagnesium bromide to isophorone.[5]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/97/Coppercatalyzedenonegrignardaddition.png/500px-Coppercatalyzedenonegrignardaddition.png)







